Introducción
El testículo no descendido es una de las patologías genitourinarias más frecuentes en la edad pediátrica, con una prevalencia del 1-4 % en varones a término, que puede aumentar hasta un 33% en prematuros. El descenso testicular espontáneo puede darse en los primeros 6 meses de vida en hasta un 35-43% de los casos. La presentación unilateral es la más frecuente, pero puede ser bilateral en un 10-20%1,2.
Se han estudiado factores étnicos, evidenciándose una menor prevalencia en países de Asia y en pacientes de raza negra, probablemente por variantes genéticas presentes en algunos grupos3.
Son múltiples los factores de riesgo asociados a criptorquidia; dentro de ellos, el antecedente familiar, la prematuridad, el bajo peso al nacer y la restricción del crecimiento intrauterino4. Factores maternos, como la edad avanzada, el consumo de alcohol o fumar durante la gestación, han mostrado en algunas investigaciones aumentar el riesgo de desarrollar criptorquidia. Así mismo, factores ambientales como la exposición a sustancias químicas (p. ej., pesticidas o parabenos) también se encuentran en estudio, ya que actúan como disruptores del sistema endocrino, interrumpiendo el descenso testicular normal5.
Clasificación
El testículo no descendido se puede clasificar según diversos criterios:
- – Etiología:
- Congénita: es la más frecuente, por un mal descenso testicular.
- Adquirida: en aproximadamente el 2% de los casos. Ocurre cuando el testículo desciende a la bolsa escrotal al nacimiento y en el primer año de vida, pero asciende en etapas posteriores y se localiza fuera de la bolsa escrotal6.
- – Localización:
- Unilateral: con leve predominio del lado izquierdo.
- Bilateral: presente hasta en un 10% de los casos7.
- – Palpación:
- Palpables (70-80%): los testículos se pueden palpar en la región inguinal (80-90%); o testes ectópicos (5%), pudiéndose encontrar en la región perineal o púbica, la base del pene o en posición contralateral; o testículos retráctiles (5%)8 (Fig. 1).
- No palpables (20-30%): los testículos se pueden encontrar en la región inguinoescrotal (30%) o la región intraabdominal (40-55%), próximos al anillo inguinal interior, la pared anterior abdominal o el espacio retroperitoneal; o testículos ausentes (15%). La ausencia testicular unilateral (monorquia unilateral) representa aproximadamente el 4% de las criptorquidias en general, y la ausencia de ambos testículos (anorquia) representa menos del 1%8 (Fig. 2).
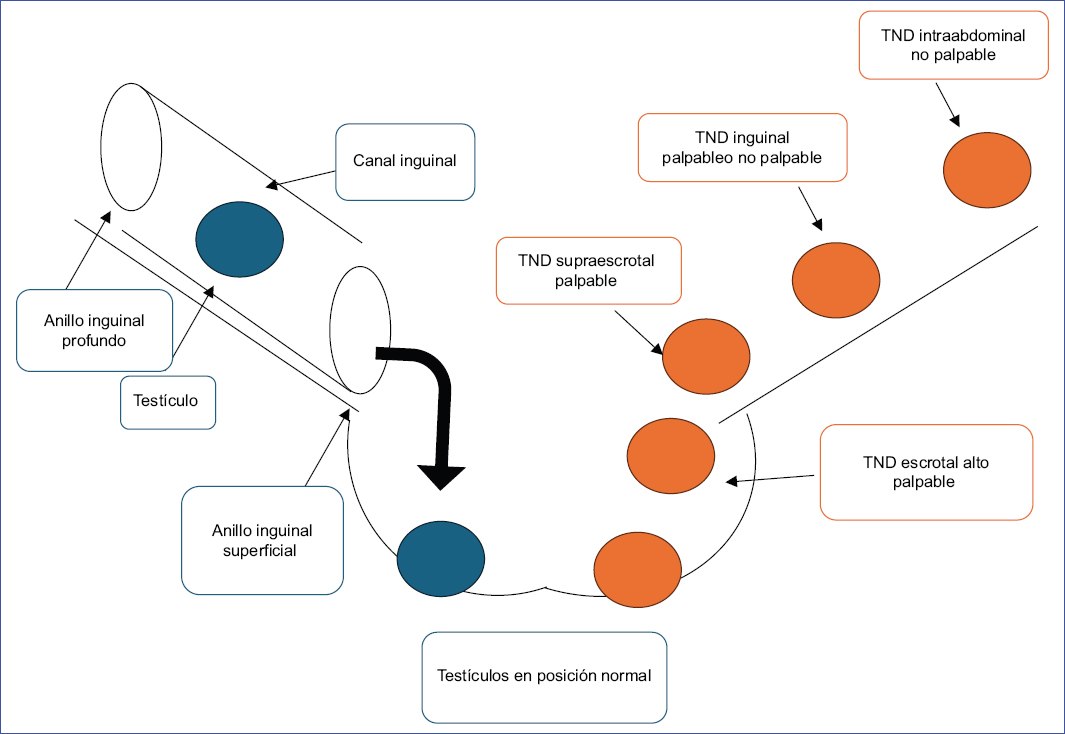
Figura 1. Localización del testículo no descendido (TND) (figura realizada por los autores).

Figura 2. Clasificación del testículo no descendido (figura realizada por los autores).
Fisiopatología
El descenso testicular está regulado por muchos factores y depende de un eje hipotalámico-pituitario-gonadal intacto9 (Fig. 3). Se observan dos fases:
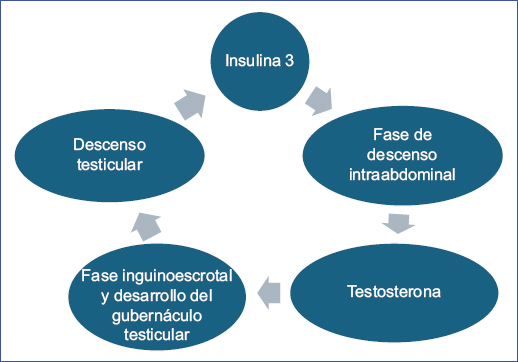
Figura 3. Mecanismos de descenso testicular (figura realizada por los autores).
- – Fase transabdominal (semanas 12 a 16): el testículo se moviliza desde la cavidad abdominal hasta el anillo inguinal profundo y está regulado por el factor similar a la insulina 3, encargado de masculinizar el gubernáculo testicular para el descenso del testículo10.
- – Fase inguinoescrotal (semanas 28 a 35): el testículo se moviliza desde el anillo inguinal profundo hacia el escroto, donde la testosterona es el principal mediador de este proceso10. El descenso en esta fase surge de la interacción de la presión abdominal, el proceso vaginal presente y la inducción androgénica11.
Diagnóstico
Se debe empezar con una detallada anamnesis, identificar factores de riesgo y realizar una minuciosa exploración física12. El diagnóstico es clínico, por palpación de la región escrotal e inguinal, con el paciente relajado en posición supina o de rana. La posición en cuclillas muchas veces facilita el examen12. Se debe examinar la zona perineal, la zona suprapúbica y la raíz del muslo, con el fin de ubicar testículos en posición ectópica y en busca de anomalías como hipospadias, transposición pene-escrotal, hernias inguinoescrotales, etc.13.
La exploración se debe realizar en un ambiente tranquilo y temperado para disminuir el efecto del reflejo cremastérico; se recomienda la palpación con las manos calientes y el niño tranquilo. En caso de encontrar un testículo retráctil, se debe explorar de forma regular; se ha documentado que un tercio de los casos se podrían convertir en testículos no descendidos adquiridos14. En la exploración física se puede apreciar un escroto liso y poco desarrollado; se apreciará asimetría en la bolsa escrotal en caso de que el testículo no descendido sea unilateral15 (Fig. 4A).
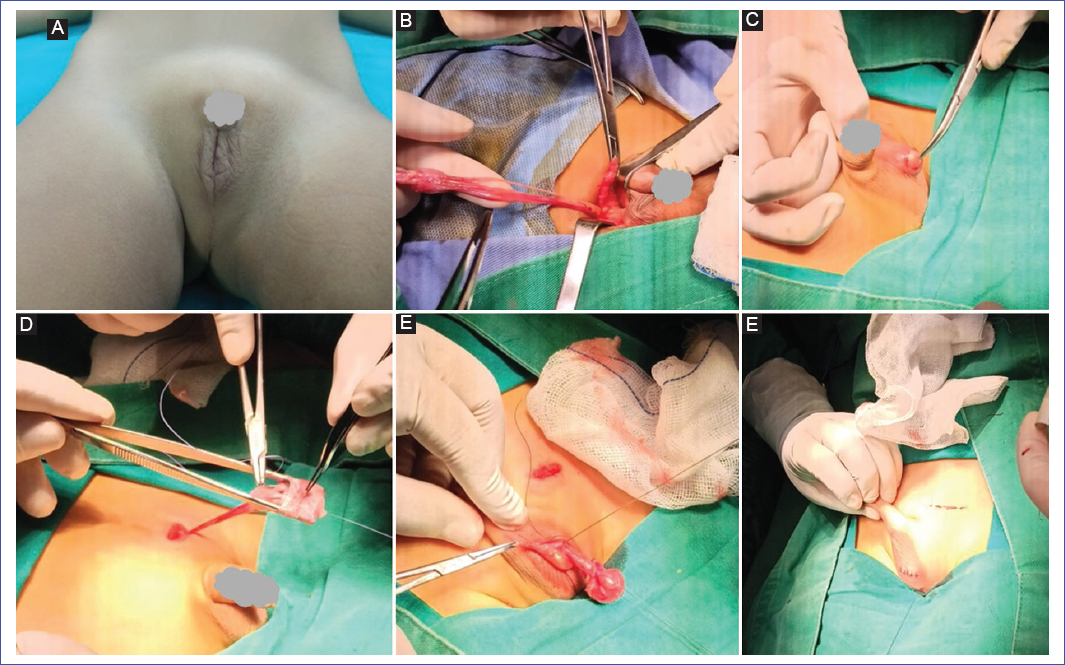
Figura 4. A: asimetría y poco desarrollo de las bolsas escrotales. B: separación del cordón espermático del proceso peritoneo vaginal. C: disección y formación de bolsa subdartica. D: colocación de puntos de fijación en mesorquio y túnica vaginal. E: testículo ubicado en bolsa escrotal y aspecto quirúrgico final.
Cualquier hipertrofia compensatoria sugiere ausencia o atrofia testicular16. La presencia de testículos no palpables bilaterales asociados a hipospadias o hernias plantea la necesidad de realización de cariotipo y evaluación genética, además de una evaluación por endocrinología pediátrica, debido a que podría tratarse de un trastorno del desarrollo sexual17.
Ante testículos no descendidos no palpables, el uso de laparoscopia es fundamental por su naturaleza mínimamente invasiva y su utilidad tanto diagnóstica como terapéutica18,19. El beneficio de las pruebas imagenológicas sigue siendo controvertido; a pesar de las muchas opciones, como ecografía, resonancia magnética y tomografía computarizada, que están ampliamente disponibles, ninguna de ellas puede predecir la posición ni la morfología de los testículos20.
En pacientes obesos con dificultad para ubicar los testículos mediante palpación podría ser útil la aplicación de ultrasonografía o en caso de necesitar identificar estructuras mullerianas; se estima que posee una sensibilidad del 45% para la localización de testículos no palpables21. En un estudio publicado por Weiss et al.22, la ultrasonografía no detectó el 30% de los testículos no descendidos palpables; a su vez, este examen presenta una elevada tasa de falsos positivos que podrían orientar a una conducta quirúrgica equivocada22.
Los medios imagenológicos se podrían emplear como evaluación morfológica y control posoperatorio23.
La tomografía computarizada no es recomendable en niños debido a su alta radiación. La resonancia magnética presenta una sensibilidad mayor del 55%, pero requiere el uso de sedación, además de tener un alto costo y baja disponibilidad en los centros hospitalarios, por lo que no es un procedimiento recomendado sistemáticamente24. La angiografía por resonancia magnética parece ser una opción futura, con una sensibilidad del 96% y una especificidad del 100% para localizar los testículos no palpables, y puede ser útil ante cualquier contraindicación para laparoscopia; sin embargo, hay que tener en cuenta su baja disponibilidad y más aún en países en vías de desarrollo25.
Tratamiento
Tratamiento quirúrgico convencional del testículo no descendido
Si un testículo no ha concluido su descenso a los 6 meses de edad (corregida por la edad gestacional), como es poco probable que más adelante ocurra el descenso espontáneo, la cirugía debe realizarse entre los 12 y 18 meses de edad26. La orquidopexia temprana puede asociarse con una recuperación parcial del crecimiento testicular, lo que no sucede si la cirugía es tardía27.
La orquidopexia inguinal es una técnica ampliamente utilizada, con una tasa de éxito de hasta el 92%28. Los pasos importantes de la orquidopexia inguinal son la movilización del testículo y el cordón espermático hasta el nivel del anillo inguinal externo, con disección y división de todas las fibras cremastéricas, para prevenir la retracción secundaria y el desprendimiento del gubernáculo testicular. El proceso vaginal permeable debe ligarse proximalmente a nivel del anillo interno29 (Fig. 4B).
Cualquier patología adicional debe ser tratada, como la remoción de un apéndice testicular (hidátide de Morgagni). Algunos niños tienen una disociación significativa entre el testículo y el epidídimo, que es de mal pronóstico para la fertilidad.
Finalmente, el testículo movilizado debe colocarse en una bolsa subdartos dentro del hemiescroto sin ninguna tensión. En caso de que la longitud lograda sea aún insuficiente, la maniobra de Prentiss, que consiste en dividir los vasos epigástricos inferiores y transponer el cordón espermático medialmente, proporciona un curso recto al escroto30. Con respecto a las suturas de fijación, si se requieren, deben realizarse entre la túnica vaginal y el músculo dartos31 (Figs. 4 C–E).
El testículo no descendido, palpable y de baja posición se puede fijar a través de una incisión escrotal que incluye la división del gubernáculo; la fijación en el escroto se lleva a cabo de manera correspondiente al abordaje inguinal. Hasta en el 20% de los casos será obligatoria una incisión inguinal para corregir una hernia inguinal asociada32,33 (Figs. 5 A–C).
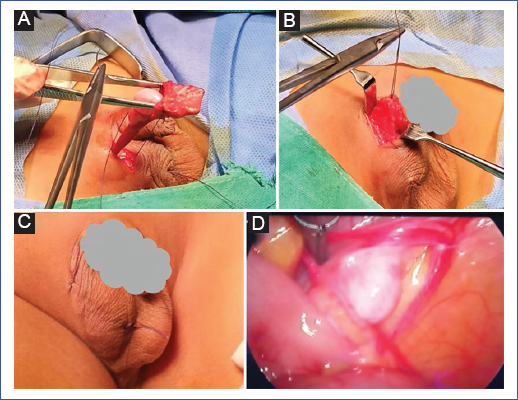
Figura 5. A: orquidopexia con técnica de Bianchi. B: cierre por planos. C: aspecto final. D: laparoscopia, imagen de testículo intraabdominal.
Las complicaciones quirúrgicas son poco frecuentes, siendo la atrofia testicular la más grave. Este fenómeno suele ser el resultado de una lesión de los vasos espermáticos durante la cirugía, tensión del cordón con isquemia posterior, torsión iatrogénica y ligaduras intencionales de los vasos. Una revisión sistemática reveló una tasa general de atrofia para la orquidopexia primaria del 1,83%34.
Tratamiento laparoscópico del testículo no descendido
El tratamiento del testículo no descendido palpable alto o no palpable siempre ha sido un gran reto para el urólogo pediatra, ya que hace tan solo una década, y con las técnicas abiertas habituales, estos pacientes terminaban muchas veces en orquiectomía o bien tenían que programarse para varias etapas quirúrgicas hasta lograr el descenso final35.
Para realizar la orquidopexia laparoscópica se introduce un trócar de 5 mm a nivel umbilical o infraumbilical para la óptica. Se crea el neumoperitoneo utilizando gas CO2, con un flujo de 1-2 l/min y una presión de 10-12 mmHg. Es ideal un laparoscopio de 30° para ayudar a la visualización de la cavidad peritoneal. Si se encuentra el testículo, se añadirán un segundo y un tercer trócares de 5 mm en las líneas medias claviculares a la altura de ambas fosas iliacas, a través de los cuales se introducirá un disector que permitirá traccionar del testículo y ver la tensión de los vasos espermáticos; en caso de encontrarse libre de tensión, se procede a la fijación36,37 (Fig. 5D).
Si los vasos se encuentran demasiado cortos, no siendo posible el descenso directo, se realiza la técnica de Fowler-Stephens, que consiste en la disección de los vasos aplicando un clip distal a unos 2-3 cm del teste, dos clips proximales y sección con tijera en la parte media, y se realizará el segundo tiempo a los 6 meses38,39.
Tratamiento hormonal
El tratamiento hormonal del testículo no descendido históricamente estaba indicado incluso antes que el manejo quirúrgico, pero se ha observado que no es eficaz para inducir el descenso testicular. La terapia hormonal con gonadotropina coriónica humana (hCG) y hormona liberadora de gonadotropina tiene una tasa de éxito limitada, del 20%; además, casi el 20% de estos testículos descendidos tienen el riesgo de volver a ascender40,41.
Los estudios han demostrado que el tratamiento con hCG podría dañar el testículo, y se ha asociado con una mayor apoptosis de células germinales en la biopsia y un menor volumen testicular en la etapa pospuberal42. Además, los testículos no descendidos que han recibido tratamiento con hCG tienen una mayor apoptosis de células germinales en comparación con los testículos descendidos quirúrgicamente; se ha observado que el volumen testicular de los niños que recibieron tratamiento con HCG se redujo en un 50% hasta la edad adulta43.
La terapia hormonal generalmente no se recomienda como tratamiento estándar en caso de testículos no descendidos bilaterales y tiene una fuerza de recomendación débil41.
Complicaciones
Cáncer testicular
Los hombres con antecedente de testículo no descendido tienen un mayor riesgo de desarrollar cáncer testicular en comparación con los hombres de la población general. El riesgo de malignidad reportado es de 5 a 10 veces mayor en la población adulta, y de 2 a 3 en los varones sometidos a orquidopexia prepuberal. Los tumores testiculares asociados a criptorquidia se presentan mayormente en pacientes de 18 a 40 años40.
La explicación histológica del desarrollo de malignidad se basa en que los gonocitos no pueden desarrollarse normalmente en pacientes con testículos no descendidos, y pueden coincidir con la transformación de estas células persistentes en carcinoma in situ y tumor de células germinales de testículo42.
Aproximadamente el 10% de los hombres con tumores de células germinativas testiculares tienen antecedente de criptorquidia. El seminoma se asocia con mayor frecuencia con testículos no descendidos, y el tumor de células germinativas no seminomatosos se asocia en la mayoría de los testículos que lograron descender. El riesgo de desarrollar cáncer testicular aumenta aún más en los hombres con criptorquidia bilateral y con testículos intraabdominales no descendidos40. Cuando se realiza la orquidopexia en edad temprana, el riesgo de cáncer de testículo no disminuye; por lo tanto, la detección y el autoexamen durante y después de la pubertad son recomendables44.
Infertilidad
Los hombres con antecedente de testículos no descendidos (incluidos los testículos ascendentes o adquiridos no descendidos) tienen una mayor incidencia de recuentos de espermatozoides más bajos, espermatozoides de peor calidad y menores tasas de fertilidad que los hombres con testículos normalmente descendidos44. Muchos factores pueden causar infertilidad, como la pérdida de células germinales, la maduración deficiente de las células germinales, la disminución de las células de Leydig y la fibrosis testicular. Estos factores provocan una falla completa de la meiosis y, por lo tanto, de la espermiogénesis44.
Los pacientes con criptorquidia albergan células germinales en los testículos al momento del nacimiento, pero estas desaparecerán a los 15 meses. Por lo tanto, el riesgo de no encontrar células germinales aumenta cuanto más tarde se realice la corrección quirúrgica44. La biopsia de testículo en la orquidopexia puede tener un uso limitado para predecir la fertilidad futura en la criptorquidia unilateral, pero clínicamente puede ser más útil para predecir el potencial de fertilidad en aquellos con criptorquidia bilateral44.
Los estudios recientes que reportan resultados para testículos no descendidos bilaterales no tratados revelan que el 100% son oligospérmicos y el 75% azoospérmicos, y en los testículos no descendidos bilaterales tratados con éxito el 75% todavía siguen siendo oligospérmicos y el 42% azoospérmicos41.
Traumatismo testicular
Los testículos no descendidos que permanecen en el canal inguinal tienen mayor riesgo de lesiones traumáticas contundentes, principalmente traumatismos de tipo cerrado, debido a la posibilidad de compresión contra el hueso púbico. Un testículo con criptorquidia es más móvil y, por lo tanto, más propenso a la torsión y al traumatismo44.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
Bibliografía
1. Shin J, Jeon GW. Comparison of diagnostic and treatment guidelines for undescended testis. Clin Exp Pediatr. 2020;63:415-21.
2. Gurney JK, McGlynn KA, Stanley J, Merriman T, Signal V, Shaw C, et al. Risk factors for cryptorchidism. Nat Rev Urol. 2017;14:534-48.
3. Alumeti D. Diagnosis and therapeutic approaches of cryptorchidism at the Panzi General Hospital, DR Congo:a 5-year retrospective study. Ethiop J Health Sci. 2020;30:107-14.
4. Stine A. The epidemiology of cryptorchidism and potential risk factors, including endocrine disrupting chemicals. Front Endocrinol (Lausanne). 2024;15:1343887.
5. Mitsui T. Effects of the prenatal environment on cryptorchidism:a narrative review. Int J Urol. 2021;28:882-9.
6. Luis Huertas AL, Espinosa Góngora R, Riñón Pastor C. Guía clínica:Escroto vacío. Adolescere. 2017;5:66-74.
7. Medina Navarro M. Criptorquidia en pediatría. En:Asociación Española de Pediatría de Atención Primaria. Algoritmos. Disponible en:https://algoritmos.aepap.org/algoritmo/88/criptorquidia-en-pediatria.
8. Kolon TF, Herndon CDA, Baker LA, Baskin LS, Baxter CG, Cheng EY, et al. Evaluation and treatment of cryptorchidism:AUA guideline. J Urol. 2014;192:337-45.
9. Liu C-C, Wang C-J, Huang S-P, Chou Y-H, Wu W-J, Huang C-H. Relationships between American Urological Association symptom index, prostate volume, and disease-specific quality of life question in patients with benign prostatic hyperplasia. Kaohsiung J Med Sci. 2004;20:273-8.
10. Kollin C, Granholm T, Nordenskjold A. Ritzén EM. Growth of spontaneously descended and surgically treated testes during early childhood. Pediatrics. 2013;131:e1174-80.
11. Imagima T, Shono T, Zakaria O. Prenatal phthalate causes cryptorchidism postnatally by inducing transambdominal ascent of the testis in fetal rats. J Pediatr Surg. 1997;32:18-21.
12. Gurney JK, McGlynn KA, Stanley J, Merriman T, Signal V, Shaw C, et al. Risk factors for cryptorchidism. Nat Rev Urol. 2017;14:534-48.
13. Canavese F, Cortese MG, Gennari F, Gesmundo R, Lala R, Sanctis D. Non palpable testes:orchiopexy at single stage. Eur J Pediatr Surg. 1995;5:104-5.
14. Sijstermans K, Hack WWM, Meijer RW, van der Voort-Doedens LM. The frequency of undescended testis from birth to adulthood:a review. Int J Androl. 2008;31:1-11.
15. Guignard JP, Sulyok E. Criptorquidism. En:Gleason CA, Devaskar SU, editores. Avery's diseases of the newborn. 9th ed. Philadelphia:Elsevier Saunders;2012. 1200-1.
16. Braga LH, Kim S, Farrokhyar F, Lorenzo AJ. Is there an optimal contralateral testicular cut-off size that predicts monorchism in boys with nonpalpable testicles?J Pediatr Urol. 2014;10:693-8.
17. Vikraman J, Hutson JM, Li R, Thorup J. The undescended testis:clinical management and scientific advances. Semin Pediatr Surg. 2016;25:241-8.
18. El-Anany F, Gad El-Moula M, Abdel Moneim A, Abdallah A, Takahashi M, Kanayama H, et al. Laparoscopy for impalpable testis:classification-based management. Surg Endosc. 2007;21:449-54.
19. Sweeney DD, Smaldone MC, Docimo SG. Minimally invasive surgery for urologic disease in children. Nat Clin Pract Urol. 2007;4:26-38.
20. Kanemoto K, Hayashi Y, Kojima Y, Maruyama T, Ito M, Kohri K. Accuracy of ultrasonography and magnetic resonance imaging in the diagnosis of non-palpable testis. Int J Urol. 2005;12:668-72.
21. Esposito C, Caldamone AA, Settimi A, El-Ghoneimi A. Management of boys with nonpalpable undescended testis. Nat Clin Pract Urol. 2008;5:252-60.
22. Weiss RM, Carter AR, Rosenfield AT. High resolution real-time ultrasonography in the localization of the undescended testis. J Urol. 1986;135:936-8.
23. Haid B, Rein P, Oswald J. Undescended testes:diagnostic algorithm and treatment. Eur Urol Focus. 2017;3:155-7.
24. Pastuszak AW, Lipshultz LI. AUA guideline on the diagnosis and treatment of cryptorchidism. J Urol. 2014;192:346-9.
25. Kolon TF, Herndon CDA, Baker LA, Baskin LS, Baxter CG, Cheng EY, et al. Evaluation and treatment of cryptorchidism:AUA guideline. J Urol. 2014;192:337-45.
26. Park KH, Lee JH, Han JJ, Lee SD, Song SY. Histological evidences suggest recommending orchiopexy within the first year of life for children with unilateral inguinal cryptorchid testis:orchiopexy for children with cryptorchid testis. Int J Urol. 2007;14:616-21.
27. Kollin C, Karpe B, Hesser U, Granholm T, Ritzén EM. Surgical treatment of unilaterally undescended testes:testicular growth after randomization to orchiopexy at age 9 months or 3 years. J Urol. 2007;178:1589-93;discussion 1593.
28. Docimo SG. The results of surgical therapy for cryptorchidism:a literature review and analysis. J Urol. 1995;154:1148-52.
29. Ziylan O, Oktar T, Korgali E, Nane I, Ander H. Failed orchiopexy. Urol Int. 2004;73:313-5.
30. Prentiss RJ, Weickgenant CJ, Moses JJ, Frazier DB. Undescended testis:surgical anatomy of spermatic vessels, spermatic surgical triangles and lateral spermatic ligament. J Urol. 1960;83:686-92.
31. Kozminski DJ, Kraft KH, Bloom DA. Orchiopexy without transparenchymal fixation suturing:a 29-year experience. J Urol. 2015;194:1743-7.
32. Na SW, Kim S-O, Hwang EC, Oh KJ, Jeong SI, Kang TW, et al. Single scrotal incision orchiopexy for children with palpable low-lying undescended testis:early outcome of a prospective randomized controlled study. Korean J Urol. 2011;52:637-41.
33. Parsons JK, Ferrer F, Docimo SG. The low scrotal approach to the ectopic or ascended testicle:prevalence of a patent processus vaginalis. J Urol. 2003;169:1832-3;discussion 1833.
34. Penson D, Krishnaswami S, Jules A, McPheeters ML. Effectiveness of hormonal and surgical therapies for cryptorchidism:a systematic review. Pediatrics. 2013;131:e1897-907.
35. Anand S, Krishnan N, PogorelićZ. Utility of laparoscopic approach of orchiopexy for palpable cryptorchidism:a systematic review and meta-analysis. Children (Basel). 2021;8:677.
36. Guo Q, Zhang Y, Lai H, Zhong W, Qiu J, Wang D. Laparoscopic assisted trans-scrotal orchiopexy versus traditional orchiopexy for inguinal cryptorchidism:a retrospective study based on 154 patients. BMC Urol. 2023;23:84.
37. Wang Y, Chen L, Cui X, Zhou C, Zhou Q, Zhang Z. Clinical effect of minimally invasive surgery for inguinal cryptorchidism. BMC Surg. 2021;21:21.
38. Tian Q, Zhao X, Zhang C, Yu K, Fang E, Zhou X, et al. Compared outcomes of high-level cryptorchidism managed by Fowler-Stephens orchiopexy versus the Shehata technique:a systematic review and meta-analysis. J Pediatr Urol. 2023;19:313-9.
39. Saylors S, Oyetunji TA. Management of undescended testis. Curr Opin Pediatr. 2024;36:554-61.
40. KO AA Gundeti MS, López P J, Rove. Pediatric Urology Book. 2023 [citado 12 de mayo de 2025]. Undescended Testis. Disponible en:https://pediatricurologybook.com/book/chapters/05-28_undescended-testis/
41. EAU Guidelines on Paediatric Urology – Uroweb [Internet]. [citado 12 de mayo de 2025]. Disponible en:https://uroweb.org/guidelines/paediatric-urology/chapter/the-guideline
42. Wein AJ, Kavoussi LR, Partin AW, Peter CA. CAMPBELL-WALSH UROLOGY, ELEVENTH EDITION.
43. Espinosa-Fernández M, López-Siguero JP. Criptorquidia. An Pediatr Contin. 1 de noviembre de 2009;7(6):333-8.
44. Kolon TF, Herndon CDA, Baker LA, Baskin LS, Baxter CG, Cheng EY, et al. Evaluation and treatment of cryptorchidism:AUA guideline. J Urol. agosto de 2014;192(2):337-45.
